7. 用价键理论计算化学反应
我们已经学习了价键理论的基本概念,以及在基态和激发态中的应用。这一讲将介绍如何用价键理论计算化学反应。我们将了解过渡态的价键波函数,以及如何利用价键理论分析化学反应。
7.1. 什么是过渡态?
化学反应的本质是籍由一定条件下化学键的断裂、生成及重组,从而由原有的物质产生出新物质的过程。原有的物质是化学反应的起点,称为反应物( Reactant, R );新生成的物质是反应的终点,称为生成物( Product, P )。在反应物向生成物变化的过程中,伴随着旧化学键的断裂及新化学键的生成,参与反应的物质会到达一个特殊的状态:此时旧化学键尚未完全断裂,新化学键虽然已经开始形成,也并未完全形成。这种状态称为 过渡态( Transition State, TS ) 。
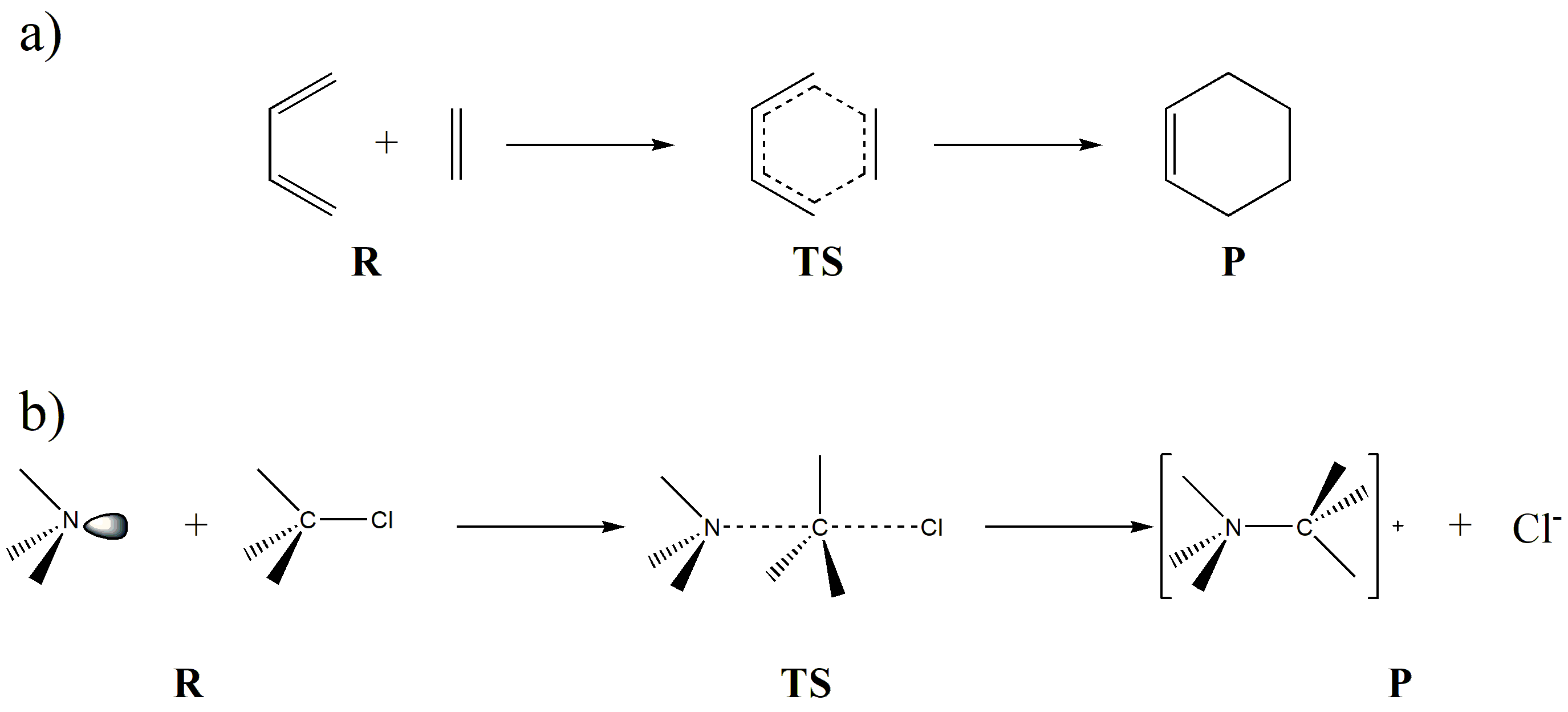
图 7.1.1 化学反应中的反应物 ( R ) 、过渡态 ( TS ) 、生成物 ( P ) 示例
图 7.1.1 给出了两个化学反应的示例。反应 a) 是一个典型的 [4+2] 成环反应,拥有一个具备六元环特征的过渡态;反应 b) 是一个典型的 \(S_N2\) 反应,在过渡态中,C-N 键尚未完全形成而 C-Cl 键尚未完全断裂,形成了 C 同时具有和 N 及 Cl 成键特性的过渡态。
在整个化学反应的势能面中,过渡态具有最高的能量。因此,过渡态和反应物的能量差决定了该化学反应发生时,反应物到生成物的过程中需要跨越的 能垒 ,也称为反应的 活化能 \(E^a\) :
7.2. 如何用XMVB计算过渡态波函数
计算过渡态的价键波函数和计算其它分子的过程没有区别。唯一需要注意的地方是:由于过渡态处于反应物和产物中间,此时的价键波函数同时具备了反应物和产物的特征,即在过渡态中,我们需要同时囊括反应物和产物的价键结构。
让我们用 H3 反应来做个例子。这个反应是一个等同氢提取反应,如 图 7.2.1 所示。在 TS 中,中间的 H 具有同时和两边的 H 原子成键的特征。

图 7.2.1 H3 氢提取反应过程
我们可以据此构造一个三中心三电子的活性空间。根据 节 2 的内容,可知此时一共有 8 个价键结构,如 图 7.2.2 所示:
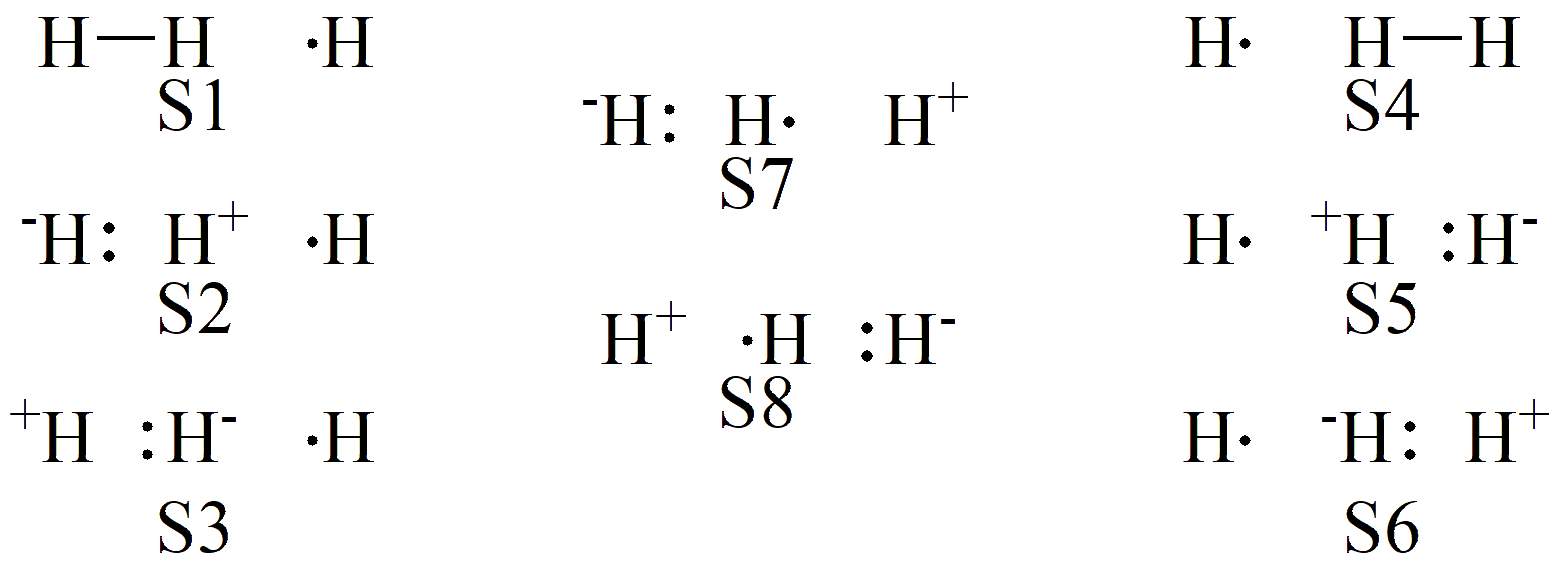
图 7.2.2 H3 氢提取反应的价键结构
我们看到,此时 8 个价键结构可以明显地分为三组:左边 S1-S3 为一组,这组主要描述了反应物 R 的成键特点;右边 S4-S6 为一组,这组主要反映了生成物 P 的成键特点;剩下中间的 S7-S8 为一组。下面以 TS 时的几何构型为例,给出输入文件:
1H3 TS
2$ctrl
3vbscf
4str=full nao=3 nae=3 nmul=2
5iscf=5
6int=libcint basis=cc-pvdz
7$end
8$orb
91*3
101
112
123
13$end
14$geo
15H 0.0 0.0 -0.93129
16H 0.0 0.0 0.00000
17H 0.0 0.0 0.93129
18$end
经过计算,我们得到了如 表 7.2.1 所列的结构系数和权重数据:
结构系数 |
结构权重 |
|
|---|---|---|
S1 |
0.378 |
0.338 |
S2 |
-0.154 |
0.106 |
S3 |
-0.039 |
0.022 |
S4 |
-0.378 |
0.338 |
S5 |
0.154 |
0.106 |
S6 |
0.039 |
0.022 |
S7 |
0.080 |
0.034 |
S8 |
-0.080 |
0.034 |
由于这个反应是一个等同氢提取反应,因此过渡态位于反应的中点。可以看到,此时反应物和产物的价键结构权重是等价的,计算结果和化学概念可以很好地对应起来。对于反应物和生成物,我们也可以用同样的价键结构进行计算。
7.3. 价键态相关图 VBSCD
在上一节中,我们看到,H3 反应的价键结构中同时出现了反应物和生成物的价键结构,而过渡态会同时体现反应物和产物的成键特点。如果我们的价键计算只包含反应物的结构,那么得到的结果就是当前构型中反应物的特性;反之,只包含生成物结构的价键计算可以提供当前构型中生成物的特性。如果我们对整个反应历程中所有的构型都进行上述计算,并将计算得到的能量绘制成图,这就是 价键态相关图( Valence Bond State Correlation Diagram, VBSCD ) 。一个典型的 H3 反应的 VBSCD 如 图 7.3.1 所示(以 TS 为零点,反应物为 -10 ,生成物为 10 ):
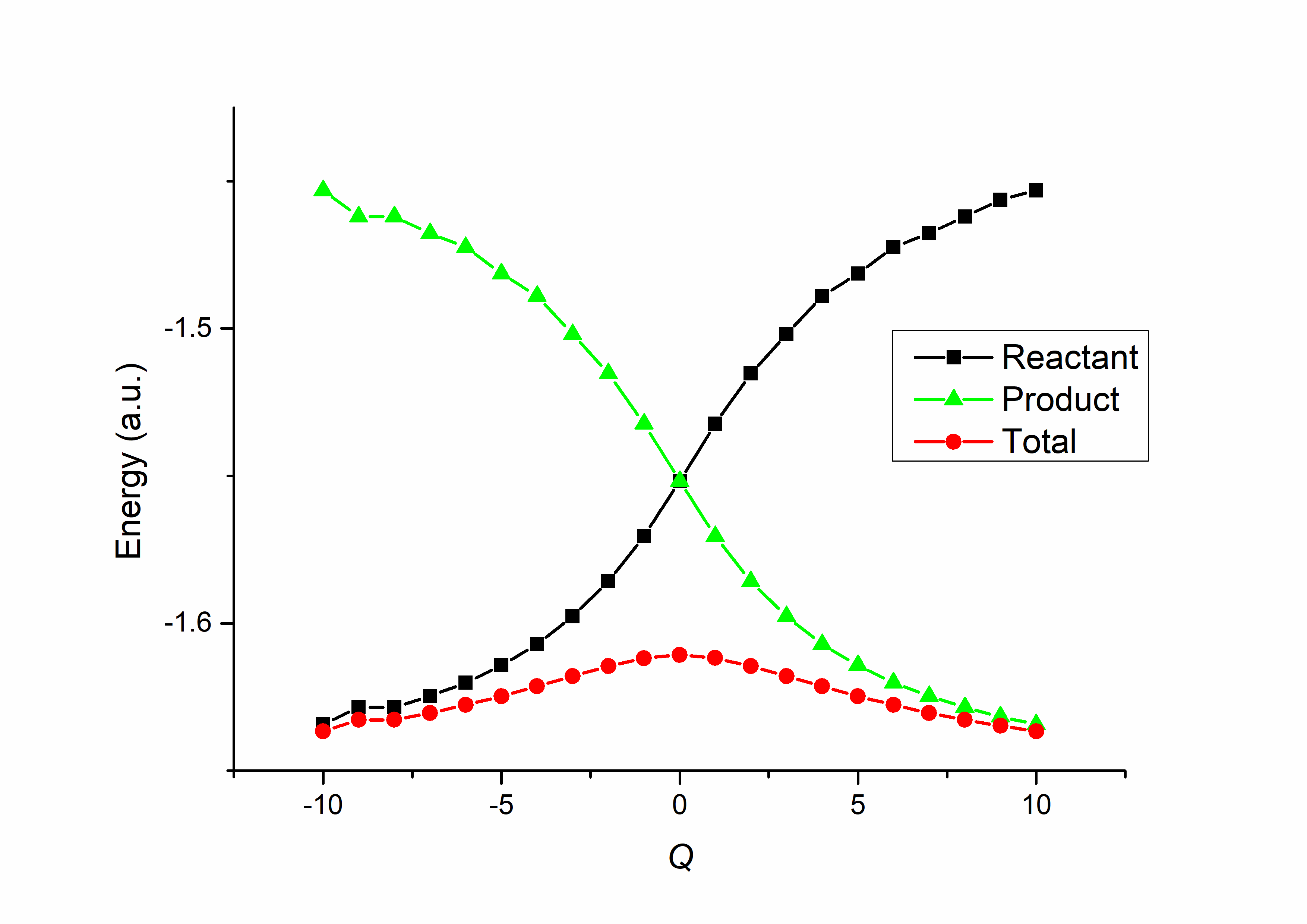
图 7.3.1 H3 氢提取反应的 VBSCD 图像
我们可以看到,随着反应的进行,代表反应物能量的黑色曲线逐渐升高,代表生成物能量的绿色曲线逐渐降低。两条曲线在中间的 TS 处交叉,代表 TS 时体系同时具有反应物和生成物的特性,且两者权重一致。在反应的两端, 代表体系总能量的红色曲线分别和反应物与生成物几乎重合,代表此时体系只有反应物或生成物的特性;在中间 TS 处,反应物/生成物的能量和体系总能量相差最大。这部分能量差就是由于引入其它结构后产生的共振能。
有关 VBSCD 更多的应用和更详细的说明,请参考以下文献: